
- Autora Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- Última modificació 2025-06-01 05:03.
Per calcular el defecte de massa : sumeu les masses de cada protó i de cada neutró que formen el nucli, resteu la real massa del nucli de la combinació massa dels components per obtenir el defecte de massa.
També cal saber què és la fórmula de defecte de massa?
El defecte de massa es pot calcular mitjançant l'equació Δm = [Z(mp + me) + (A - Z)m] - màtom, on: Δm = defecte de massa [atòmic massa unitat (amu)]; mpàg = massa d'un protó (1,007277 amu); m = massa d'un neutró (1,008665 amu); me = massa d'un electró (0,000548597 amu); màtom = massa del nuclid X Z A (amu); Z = nombre atòmic
De la mateixa manera, el defecte de massa és negatiu o positiu? nuclear defecte de massa és un negatiu valor i té el mateix signe per a tots els elements i, per tant, les energies d'unió ja que l'energia que manté el nucli unit tindrà el mateix signe que s'esperava. D'altra banda, química defecte de massa és positiu per a alguns i negatiu per als altres.
Simplement així, què causa un defecte de massa?
A defecte de massa és la diferència entre els àtoms massa i la suma de la masses dels seus protons, neutrons i electrons. El raó l'actual massa és diferent de la masses dels components és perquè alguns dels massa s'allibera com a energia quan protons i neutrons s'uneixen al nucli atòmic.
Per què és important el defecte massiu?
Defecte de massa és la quantitat de matèria convertida en energia en la formació d'un nucli atòmic. La causa és aconseguir una configuració nuclear més estable.
Recomanat:
Què determina el nombre quàntic principal?

El nombre quàntic principal, n, descriu l'energia d'un electró i la distància més probable de l'electró al nucli. En altres paraules, es refereix a la mida de l'orbital i al nivell d'energia en què es col·loca un electró. El nombre de subcapa, o l, descriu la forma de l'orbital
Com es determina la massa atòmica mitjana que es mostra a la taula periòdica?

La massa atòmica mitjana d'un element es calcula sumant les masses dels isòtops de l'element, cadascun multiplicat per la seva abundància natural a la Terra. Quan feu qualsevol càlcul de massa que inclogui elements o compostos, utilitzeu sempre la massa atòmica mitjana, que es pot trobar a la taula periòdica
Quina diferència hi ha entre la massa d'un protó i la massa d'un electró?
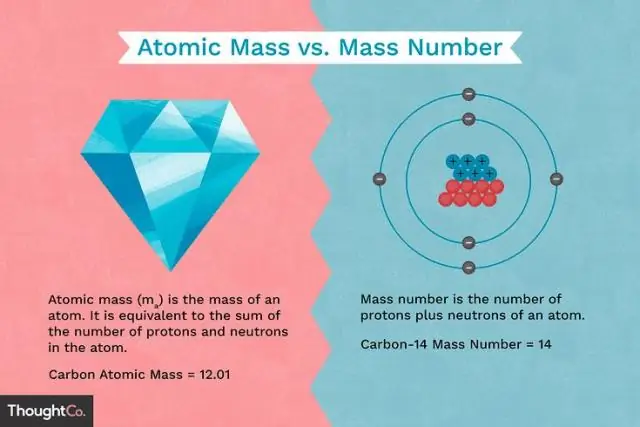
Els protons i els neutrons tenen aproximadament la mateixa massa, però tots dos són molt més massius que els electrons (unes 2.000 vegades més massius que un electró). La càrrega positiva d'un protó és igual en magnitud a la càrrega negativa d'un electró
Com es resolen els problemes de massa de massa reactiva limitant?

Trobeu el reactiu limitant calculant i comparant la quantitat de producte que produirà cada reactiu. Equilibra l'equació química de la reacció química. Converteix la informació donada en lunars. Utilitzeu l'estequiometria per a cada reactiu individual per trobar la massa del producte produït
Per què una estrella de massa gran evoluciona de manera diferent a una estrella de massa baixa?

Per què una estrella de massa gran evoluciona de manera diferent que una estrella de massa baixa? A) Pot cremar més combustibles perquè el seu nucli es pot escalfar. Té una gravetat més baixa, de manera que no pot treure més combustible de l'espai
