
Taula de continguts:
- Autora Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- Última modificació 2025-01-22 16:56.
Basicitat de les amines
Amines són bàsics perquè posseeixen un parell d'electrons no compartits, que poden compartir amb altres àtoms. Aquests electrons no compartits creen una densitat d'electrons al voltant de l'àtom de nitrogen. Com més gran sigui la densitat d'electrons, més bàsica serà la molècula
A més d'això, quin és l'ordre de basicitat de les amines?
Alifàtic amines (pKb = 3 a 4,22) són bases més fortes que l'amoníac (pKb =4,75) a causa de l'efecte +I dels grups alquil que augmenta la densitat e- a l'àtom de nitrogen. En fase gasosa: R3N > R2NH > RNH2 > NH3 (regit per l'efecte +I dels grups alquil). arilalquil amines tenir amina - grups units indirectament als anells aromàtics.
A més, per què les amines terciàries són més bàsiques? Amines i amoníac Això es deu a l'efecte donador d'electrons dels grups alquil que augmenten la densitat d'electrons del nitrogen. Amines terciàries tenir més grups R donants d'electrons i augmentar la densitat d'electrons del nitrogen en major mesura. D'aquí el més R agrupa els amina té, el més bàsic és.
En aquest sentit, quina és l'amina més bàsica?
Com que els grups alquil donen electrons al nitrogen més electronegatiu. L'efecte inductiu fa que la densitat d'electrons del nitrogen de l'alquilamina sigui més gran que el nitrogen de amoni . En conseqüència, les alquil amines primàries, secundàries i terciàries són més bàsiques que amoníac.
Les amines són àcides o bàsiques?
Segons l'àcid de Lewis- base concepte, amines poden donar un parell d'electrons, per tant són bases de Lewis. A més, les bases de Brønsted-Lowry poden acceptar un protó per formar ions d'amoni substituïts. Tan, amines són bases tant segons les teories de Lewis com les de Brønsted-Lowry.
Recomanat:
Quina part cel·lular tenen les cèl·lules animals per ajudar-les a completar la citocinesi?
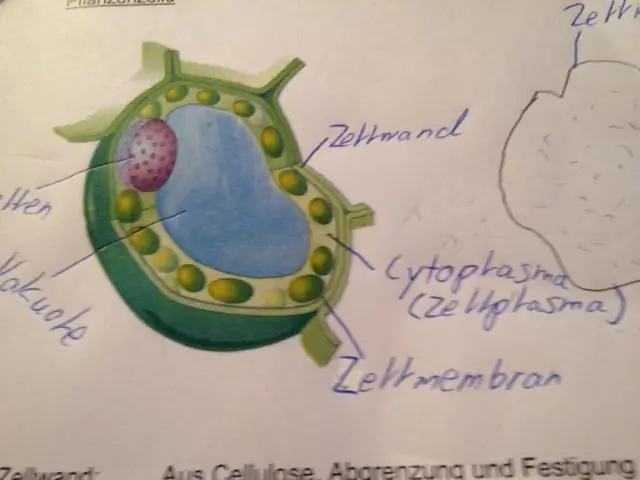
Les cèl·lules animals es divideixen per un solc d'escissió. Les cèl·lules vegetals es divideixen per una placa cel·lular que finalment es converteix en la paret cel·lular. El citoplasma i les membranes cel·lulars són necessaris per a la citocinesi tant en plantes com en animals
Quina diferència hi ha entre les galàxies espirals i les galàxies espirals barrades?

Quina diferència hi ha entre una galàxia espiral barrada i una galàxia el·líptica? Una espiral barrada consta de dos o més braços espirals en un disc pla, on els braços estan connectats per una barra d'estrelles. La barra i els braços espirals són regions actives de formació estel·lar. El centre de la barra és normalment una protuberància esfèrica
Quina capa atmosfèrica i quina altitud solen tenir les temperatures més càlides?

Termosfera
Per què la basicitat disminueix amb la mida?

La basicitat disminueix quan es baixa el grup en una taula periòdica amb els elements, a causa de l'augment de la mida dels àtoms en baixar pel grup. Explicació: I així augmenta el caràcter metàl·lic de l'àtom i, per tant, disminueix la basicitat
Per què la basicitat dels hidrurs disminueix en el grup?

A causa de la presència de parells d'electrons solitaris, els hidrurs d'aquests elements són de naturalesa bàsica (bases de Lewis). La basicitat disminueix amb la mida de l'àtom central a causa de la difusió d'electrons sobre un gran volum, és a dir, pel grup, a mesura que la mida dels elements augmenta la densitat d'electrons de l'element disminueix
