
- Autora Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- Última modificació 2025-01-22 16:56.
Observeu una diferència clau entre el general diagrama de fases i la diagrama de fases per aigua . El motiu és que aigua és una substància inusual perquè el seu estat sòlid és menys dens que l'estat líquid. El gel flota en líquid aigua . Per tant, un canvi de pressió té l'efecte contrari en aquests dos fases.
D'això, en què es diferencia el diagrama de fases de l'aigua de la resta de substàncies?
El diagrama de fases per a la majoria substàncies sembla aquest. Així, el pendent negatiu indica que el líquid fase té una densitat més gran que el sòlid fase . En altres paraules, la densitat del gel és menor que la de aigua . Per a la majoria dels altres comuns substàncies , el sòlid és més dens que el líquid.
De la mateixa manera, en què es diferencien el diagrama de fases per a l'aigua i el diòxid de carboni? A diferència diòxid de carboni i la majoria de les altres substàncies, el diagrama de fases de aigua mostra un pendent negatiu per a la línia límit entre l'estat líquid i sòlid. Això diferència ha de fer amb aquest fet que aigua en realitat s'expandeix a mesura que passa de l'estat líquid a l'estat sòlid.
Quin és el propòsit d'un diagrama de fases?
A diagrama de fases en química física, enginyeria, mineralogia i ciència dels materials és un tipus de gràfic que s'utilitza per mostrar condicions (pressió, temperatura, volum, etc.) a les quals es distingeixen termodinàmicament fases (com els estats sòlid, líquid o gasós) es produeixen i coexisteixen en equilibri.
Per què els diagrames de fases són diferents per a cada substància?
En avaluar el diagrama de fases , val la pena assenyalar que el sòlid-líquid fase límit en el diagrama de fases de la majoria substàncies té un pendent positiu. Això es deu al sòlid fase tenint una densitat superior a la del líquid, de manera que augmentant la pressió augmenta la temperatura de fusió.
Recomanat:
Com és diferent l'aigua per sota del seu punt de fusió i per sobre?

Com és diferent l'aigua per sota del seu punt de fusió i per sobre? A sota roman junts i reboten l'un de l'altre. A sobre les molècules s'acosten encara més que a sota. El punt d'ebullició/condensació de l'aigua és de 373K
Com pot ajudar els enllaços d'hidrogen entre les molècules d'aigua a explicar la capacitat de l'aigua per absorbir grans quantitats d'energia abans de l'evaporació?

Els ponts d'hidrogen de l'aigua li permeten absorbir i alliberar energia tèrmica més lentament que moltes altres substàncies. La temperatura és una mesura del moviment (energia cinètica) de les molècules. A mesura que augmenta el moviment, l'energia és més alta i, per tant, la temperatura és més alta
Per què els colors es veuen diferents amb una il·luminació diferent?

Els objectes apareixen de diferents colors perquè absorbeixen alguns colors (longituds d'ona) i reflecteixen o transmeten altres colors. Per exemple, una camisa vermella sembla vermella perquè les molècules de colorant del teixit han absorbit les longituds d'ona de la llum de l'extrem violeta/blau de l'espectre
Quina és la composició eutèctica del diagrama de fases del carboni del ferro?

La concentració eutèctica de carboni és del 4,3%. A la pràctica només s'utilitzen aliatges hipoeutèctics. Aquests aliatges (contingut de carboni del 2,06% al 4,3%) s'anomenen ferros colats. Quan la temperatura d'un aliatge d'aquest rang arriba als 2097 ºF (1147 ºC), conté cristalls primaris d'austenita i una part de la fase líquida
Per què l'aigua té un diagrama de fases de pendent negatiu?
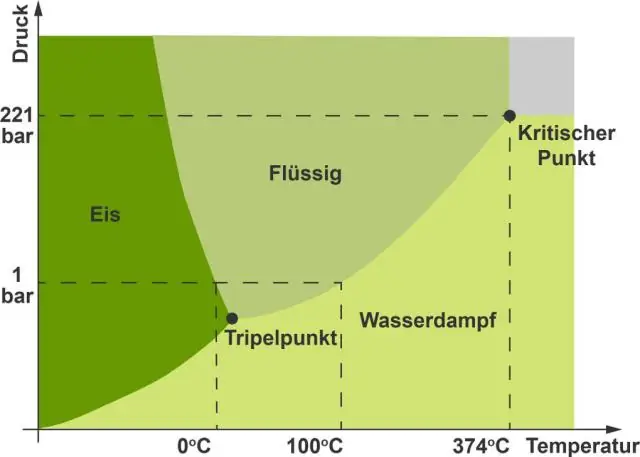
En el diagrama de l'aigua, el pendent de la línia entre els estats sòlid i líquid és negatiu en lloc de positiu. La raó és que l'aigua és una substància inusual, ja que el seu estat sòlid és menys dens que l'estat líquid
