
- Autora Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- Última modificació 2025-01-22 16:56.
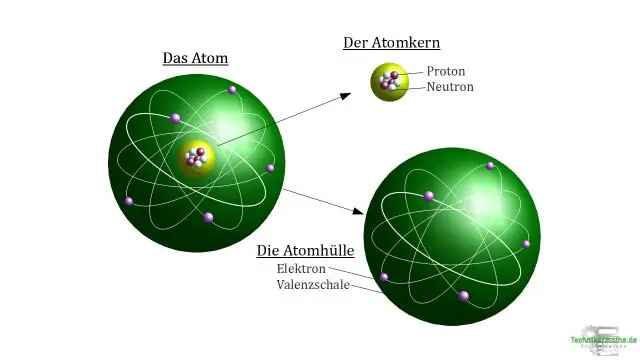
El nombre atòmic representa la nombre de protons en un l'àtom nucli. En un àtom sense càrrega , el nombre de protons és sempre igual al nombre d'electrons . Per exemple, el carboni àtoms inclou sis protons i sis electrons , doncs de carboni nombre atòmic és 6.
De la mateixa manera, us podeu preguntar, com trobeu el nombre d'electrons?
El nombre d'electrons en un àtom neutre és igual a nombre de protons. La massa nombre de l'àtom (M) és igual a la suma dels nombre de protons i neutrons al nucli. El nombre de neutrons és igual a la diferència entre la massa nombre de l'àtom (M) i de l'atòmic nombre (Z).
També es pot preguntar, quants electrons hi ha en un àtom de 235u? El 235U(4+), per exemple, contindria 92 - 4 = 88 electrons. Troba el nombre de neutrons de l'isòtop restant el nombre de protons del nombre de massa indicat en el símbol. Per exemple, 235U, que conté 92 protons, per tant conté 235 - 92 = 143 neutrons.
També la pregunta és, com puc determinar el nombre de protons, neutrons i electrons en un àtom neutre o sense càrrega?
El nombre de neutrons és igual a la massa nombre del àtom menys el nombre atòmic . El nombre atòmic i mitjana atòmic massa (la mitjana ponderada de la massa nombre de tots els isòtops) es pot trobar a la taula periòdica. El nombre de electrons en àtoms neutres i isòtops iguals el nombre de protons.
Per què un àtom està sense càrrega?
Normal àtoms són elèctricament sense càrrega o neutre. electrons, prenen una càrrega negativa perquè cadascun àtom ara té més electrons que protons. Tant l'electricitat estàtica com la corrent es poden explicar pel moviment dels electrons de càrrega negativa àtoms a carregar positivament àtoms fins a aconseguir un equilibri.
Recomanat:
Quina és la càrrega d'un àtom que guanya electrons?
Un ió és un àtom que ha guanyat o perdut un o més electrons i, per tant, té una càrrega negativa o positiva. Un catió és un àtom que ha perdut un electró de valència i, per tant, té més protons positius que electrons negatius, de manera que està carregat positivament
Què és cert d'un àtom sense càrrega?

Mentre el nombre de protons d'un àtom sigui igual al nombre d'electrons, l'àtom roman sense càrrega o neutre. Quan un àtom guanya o perd electrons, es converteix en un ió carregat elèctricament
Com es troba el nombre màxim d'electrons?

Afegiu els electrons per a cada orbital complet Afegiu el nombre màxim d'electrons que pot contenir cada orbital complet. Anoteu aquest nombre per al seu ús posterior. Per exemple, el primer orbital pot contenir dos electrons; el segon, vuit; i el tercer, 18. Per tant, els tres orbitals combinats poden contenir 28 electrons
Quants electrons té un àtom d'estany sense càrrega?

Aquest àtom d'estany té 50 protons, 69 neutrons i 48 electrons
Per què el nombre de protons és igual al nombre d'electrons?

L'estructura dels àtoms. Un àtom està format per un nucli carregat positivament envoltat d'una o més partícules carregades negativament anomenades electrons. El nombre de protons que es troben al nucli és igual al nombre d'electrons que l'envolten, donant a l'àtom una càrrega neutra (els neutrons tenen càrrega zero)
