
- Autora Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- Última modificació 2025-01-22 16:56.
En a cèl·lula voltaica , el oxidació i reducció de metalls es produeix als elèctrodes. Hi ha dos elèctrodes en a cèl·lula voltaica , un a cada meitat- cel·la . El càtode és on es produeix la reducció i oxidació té lloc a l'ànode.
Tenint en compte això, on es produeix l'oxidació en una cèl·lula?
Oxidació té lloc a l'ànode de l'electroquímic cel·la . Aquí és on el metall de l'ànode perd electrons.
Al costat de dalt, què passa en una cel·la galvànica? A galvànica ( voltaica ) cel·la utilitza l'energia alliberada durant una reacció redox espontània (ΔG<0) per generar electricitat. La mitja reacció d'oxidació es produeix en un elèctrode (l'ànode) i la semireacció de reducció es produeix a l'altre (el càtode).
En conseqüència, on es produeix l'oxidació a la cèl·lula electrolítica?
Hi ha dos tipus d'elèctrodes en un cèl·lula electroquímica , l'ànode i el càtode. Oxidació sempre es produeix a l'ànode mentre que la reducció sempre es produeix al càtode.
És l'oxidació d'ATP a ADP?
Va de ATP a ADP i un fosfat inorgànic an oxidació reacció o reacció de reducció, i per què? ATP a ADP + Pi és una reducció; ADP és la forma reduïda. Això es deu al canvi en el oxidació estat. Tot i que el càrrec no canvia, el oxidació l'estat disminueix.
Recomanat:
Quines són les 3 diferències entre una cèl·lula vegetal i una cèl·lula animal?

Les cèl·lules vegetals tenen una paret cel·lular a més de les seves membranes cel·lulars, mentre que les cèl·lules animals només tenen una membrana circumdant. Tant les cèl·lules vegetals com les animals tenen vacúols, però són molt més grans a les plantes, i generalment només hi ha 1 vacúol a les cèl·lules vegetals, mentre que les cèl·lules animals en tindran diversos de més petits
En què difereix la forma d'una cèl·lula vegetal de la d'una cèl·lula animal?
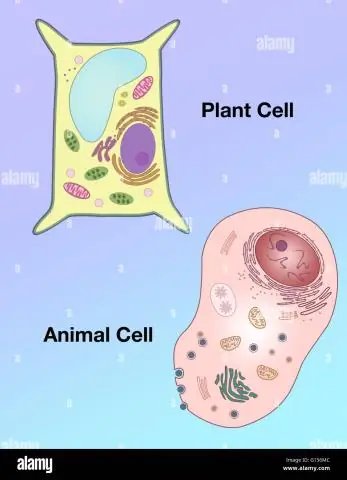
Vacúols: les cèl·lules vegetals tenen un vacúol gran, mentre que les cèl·lules animals contenen múltiples vacúols petits. Forma: les cèl·lules vegetals tenen una forma més regular (generalment rectangular), mentre que les cèl·lules animals tenen formes irregulars. Lisosomes: generalment estan presents a les cèl·lules animals, mentre que estan absents a les cèl·lules vegetals
Com pot una proteïna fora de la cèl·lula provocar esdeveniments dins de la cèl·lula?
Una proteïna pot travessar la membrana i entrar a la cèl·lula, provocant senyals dins de la cèl·lula. b. Una proteïna fora de la cèl·lula pot unir-se a una proteïna receptora a la superfície cel·lular, fent que canviï de forma i enviant un senyal dins de la cèl·lula. La fosforilació canvia la forma de la proteïna, la majoria de vegades activant-la
Quin tipus de cèl·lula és una cèl·lula de galta?

Cèl·lules epitelials de galtes humanes. El teixit que recobreix l'interior de la boca es coneix com a mucosa basal i està format per cèl·lules epitelials escamoses. Aquestes estructures, comunament considerades com a cèl·lules de la galta, es divideixen aproximadament cada 24 hores i s'eliminen constantment del cos
Com es compara el material genètic de cada nova cèl·lula formada per divisió cel·lular amb el material genètic de la cèl·lula original?

La mitosi dóna lloc a dos nuclis idèntics al nucli original. Així, les dues noves cèl·lules que es formen després de la divisió cel·lular tenen el mateix material genètic. Durant la mitosi, els cromosomes es condensen a partir de la cromatina. Quan es miren amb un microscopi, els cromosomes són visibles dins del nucli
