
- Autora Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- Última modificació 2025-01-22 16:56.
Per què es separen els dos components d'una cel·la galvànica l'un de l'altre? Els metalls es col·loquen a la meitat cèl · lules que estan connectats per un pont de sal. El moviment dels electrons d'ànode a càtode és el corrent elèctric.
Aquí, per què els dos components de la cèl·lula estan separats entre si?
En una galvànica cel·la hi ha dos mig- cèl · lules . Cadascú mig- cel·la conté un elèctrode en un electròlit. El separació És necessari evitar el contacte químic directe de les reaccions d'oxidació i reducció, creant una diferència de potencial.
Sapigueu també, per a què serveixen les cèl·lules galvàniques? Cèl·lules galvàniques . Entre altres cèl · lules , a galvànica la cèl·lula és un tipus de electroquímics cel·la. És utilitzat per subministrar corrent elèctric fent la transferència d'electrons mitjançant una reacció redox. A galvànica la cèl·lula és una idea exemplar de com es pot aprofitar l'energia mitjançant reaccions senzilles entre uns quants elements donats.
Així doncs, per què hi ha 2 mitges cel·les en una cel·la electroquímica?
Cèl·lules electroquímiques consisteixen normalment en dues meitats - cèl · lules . La meitat - cèl · lules separat el oxidació la meitat -reacció de el reducció la meitat -reacció i fan possible que el corrent circuli per un cable extern. La reducció es produeix a el càtode. S'ha completat l'addició d'un pont de sal el circuit que permet el pas del corrent.
Quins són els dos tipus de cèl·lules electroquímiques?
Dos Tipus de Cèl·lula N'hi ha dos fonamental tipus de cèl·lules electroquímiques : galvànica i electrolític. Cèl·lules galvàniques convertir l'energia potencial química en energia elèctrica. La conversió d'energia s'aconsegueix mitjançant reaccions redox espontànies (ΔG < 0) produint un flux d'electrons.
Recomanat:
Quines són les 3 diferències entre una cèl·lula vegetal i una cèl·lula animal?

Les cèl·lules vegetals tenen una paret cel·lular a més de les seves membranes cel·lulars, mentre que les cèl·lules animals només tenen una membrana circumdant. Tant les cèl·lules vegetals com les animals tenen vacúols, però són molt més grans a les plantes, i generalment només hi ha 1 vacúol a les cèl·lules vegetals, mentre que les cèl·lules animals en tindran diversos de més petits
En què difereix la forma d'una cèl·lula vegetal de la d'una cèl·lula animal?
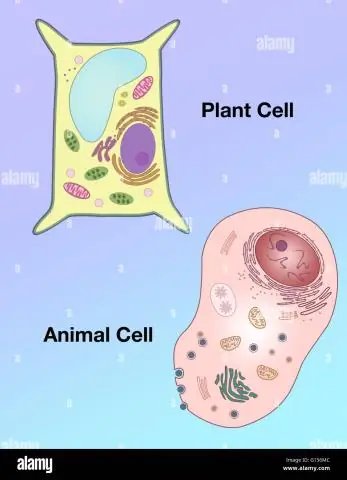
Vacúols: les cèl·lules vegetals tenen un vacúol gran, mentre que les cèl·lules animals contenen múltiples vacúols petits. Forma: les cèl·lules vegetals tenen una forma més regular (generalment rectangular), mentre que les cèl·lules animals tenen formes irregulars. Lisosomes: generalment estan presents a les cèl·lules animals, mentre que estan absents a les cèl·lules vegetals
Per què els colors d'interferència són més evidents per a pel·lícules primes que per a pel·lícules gruixudes?

S'està produint una interferència de llum de les superfícies superior i inferior de la pel·lícula de sabó o detergent. Per què els colors d'interferència són més evidents per a pel·lícules primes que per a pel·lícules gruixudes? A causa de la interferència de les ones, es veu que una pel·lícula d'oli sobre l'aigua a la llum del sol és groga per als observadors situats directament a dalt d'un avió
Quins quatre components cel·lulars comparteixen les cèl·lules procariotes i eucariotes?

Resum Totes les cèl·lules tenen membrana plasmàtica, ribosomes, citoplasma i ADN. Les cèl·lules procariotes no tenen nucli i estructures lligades a la membrana. Les cèl·lules eucariotes tenen un nucli i unes estructures lligades a la membrana anomenades orgànuls
Com es compara el material genètic de cada nova cèl·lula formada per divisió cel·lular amb el material genètic de la cèl·lula original?

La mitosi dóna lloc a dos nuclis idèntics al nucli original. Així, les dues noves cèl·lules que es formen després de la divisió cel·lular tenen el mateix material genètic. Durant la mitosi, els cromosomes es condensen a partir de la cromatina. Quan es miren amb un microscopi, els cromosomes són visibles dins del nucli
