
- Autora Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- Última modificació 2025-01-22 16:56.
Així doncs, nosaltres calcular ho prenent el ponderat massa de cadascun dels isòtops i sumant-los. Per tant, pel primer massa , multiplicarem el 0,50% de 84 (amu - massa atòmica unitats) = 0,042 amu, i afegiu-lo al 9,9% de 86 amu = 8,51 amu, i així successivament.
Posteriorment, també es pot preguntar, com es calcula la massa atòmica mitjana?
Càlcul de la massa atòmica mitjana El massa atòmica mitjana d'un element és la suma dels masses dels seus isòtops, cadascun multiplicat per la seva abundància natural (el decimal associat al percentatge de àtoms d'aquest element que són d'un isòtop determinat). Massa atòmica mitjana = f1M1 + f2M2 +…
Sapigueu també quins tres tipus d'informació es necessiten per calcular una massa atòmica mitjana? El nombre d'isòtops que existeixen per a l'element. El Atòmic Número per a l'element. El percentatge d'abundància de cada isòtop.
També es pot preguntar, quin valor és el més proper a la massa atòmica de l'estronci?
Estronci . En el seu informe de 1961, la Comissió va recomanar a Ar(Sr) = 87,62 basat en el massa -determinació espectromètrica de Nier. Això valor va ser revisat a Ar(Sr) = 87,62(1) el 1969 i es manté sense canvis des de llavors.
Què té una massa d'1 amu?
Una unitat de massa atòmica (simbolitzada AMU o amu) es defineix com precisament 1/12 de la massa d'un àtom de carboni-12. L'àtom de carboni-12 (C-12) té sis protons i sis neutrons en el seu nucli. En termes imprecisos, una AMU és la mitjana de la protó massa de repòs i la neutró massa de repòs.
Recomanat:
Quina és la massa atòmica mitjana d'un àtom?

La massa atòmica mitjana d'un element és la suma de les masses dels seus isòtops, cadascuna multiplicada per la seva abundància natural (el decimal associat al percentatge d'àtoms d'aquest element que són d'un isòtop determinat). Massa atòmica mitjana = f1M1 + f2M2 +
Quin és el color de la flama de l'estronci?

Proves de flama Color de l'element Vermell rubidi (vermell-violeta) Blau cesi/violeta (vegeu més avall) Vermell taronja calci Vermell estronci
Com es determina la massa atòmica mitjana que es mostra a la taula periòdica?

La massa atòmica mitjana d'un element es calcula sumant les masses dels isòtops de l'element, cadascun multiplicat per la seva abundància natural a la Terra. Quan feu qualsevol càlcul de massa que inclogui elements o compostos, utilitzeu sempre la massa atòmica mitjana, que es pot trobar a la taula periòdica
Com es calcula la massa atòmica del bor?
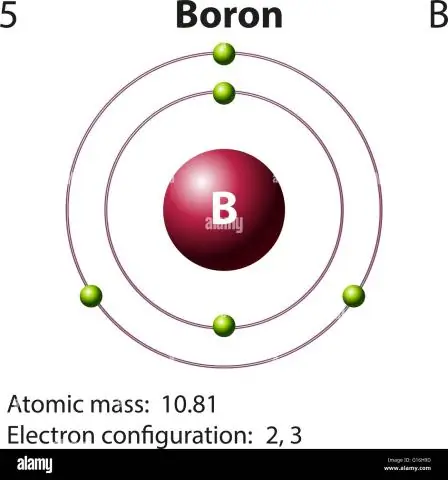
Per al bor, aquesta equació tindrà aquest aspecte: 5 protons + 5 neutrons = 10 unitats de massa atòmica (AMU) o, per a l'isòtop de bor més freqüent (aproximadament 5 protons + 6 neutrons = 11 AMU)
Quina és la temperatura mitjana mitjana de la Terra?

La temperatura mitjana nacional va ser de 2,91 °C (5,24 °F) per sobre de la mitjana de 1961-1990, trencant el rècord anterior establert el 2013 en 0,99 °C (1,78 °F)
