
- Autora Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- Última modificació 2025-01-22 16:56.
Aquí, hem de trencar el C=C llaç en etè, i el H-H llaç en H2. (Veure Energia d'enllaç taula al final d'aquesta pàgina) A H-H llaç l'entalpia (BE) és de 436 kJ/mol, a C=C llaç és 602 kJ/mol, a Enllaç C-C és de 346 kJ/mol i un C-H BE és de 413 kJ/mol.
De la mateixa manera, es pregunta, quina és l'energia de dissociació d'enllaços per a CC?
Energies d'enllaç comuns (D
| Llaç | D (kJ/mol) | r (pm) |
|---|---|---|
| C-C | 346 | 154 |
| C=C | 602 | 134 |
| C≡C | 835 | 120 |
| C-Si | 318 | 185 |
Sapigueu també, quina és l'energia d'enllaç del CO? El energia d'enllaç de C=O, és a dir, el energia canvi per la reacció CO (g) → C(g) + O(g) és 1079 kJ/mol. Aquest és el més fort llaç conegut per una molècula diatòmica. Però això és atípic en cert sentit, ja que és més aviat un triple llaç que un doble llaç.
D'aquesta manera, com es calcula l'energia d'enllaç?
Energia d'enllaç es defineix per la suma de tots els enllaços trencat menys la suma de tots els enllaços format: ΔH = ∑H( enllaços trencat) - ∑H( enllaços format). ΔH és el canvi en energia d'enllaç , també conegut com a llaç entalpia i ∑H és la suma de la energies d'enllaç per a cada costat de l'equació.
Quin enllaç és més fort CC o CO?
Com és el Enllaç C-O més fort que el Enllaç C-C , però el C-N llaç és més feble que tots dos enllaços ? Té sentit que CO és més fort que C-C . La diferència d'electronegativitat és més gran, la qual cosa augmenta el caràcter iònic mentre que l'àtom d'oxigen és més petit, la qual cosa augmenta la superposició orbital.
Recomanat:
En què es diferencia un enllaç covalent d'un quizlet d'enllaç iònic?

La diferència entre un enllaç iònic i un enllaç covalent és que es forma un enllaç covalent quan dos àtoms comparteixen electrons. Els enllaços iònics són forces que mantenen unides les forces electrostàtiques d'atraccions entre ions de càrrega oposada. Els enllaços iònics tenen una diferència d'electronegativitat superior o igual a 2
Quina diferència hi ha entre l'energia d'enllaç i l'energia de dissociació d'enllaç?

La principal diferència entre l'energia d'enllaç i l'energia d'associació d'enllaç és que l'energia d'enllaç és la quantitat mitjana d'energia necessària per trencar tots els enllaços entre els mateixos dos tipus d'àtoms en un compost, mentre que l'energia de dissociació d'enllaç és la quantitat d'energia necessària per trencar un enllaç particular en l'homòlisi
És el mateix un enllaç d'hidrogen que un enllaç covalent?
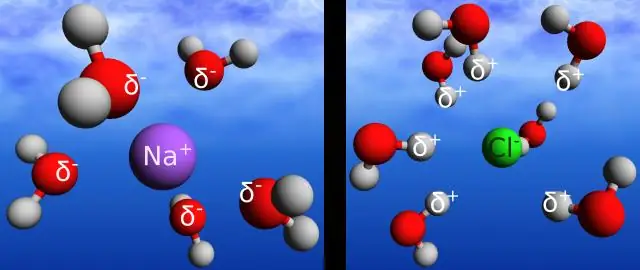
L'enllaç d'hidrogen és el nom que es dóna a la interacció electrostàtica entre la càrrega positiva d'un àtom d'hidrogen i la càrrega negativa de l'àtom d'oxigen d'una molècula veïna. L'enllaç covalent és la interacció electrostàtica entre dos àtoms d'una mateixa molècula
Quina és la definició de la teoria de l'enllaç de valència?

La teoria de l'enllaç de valència (VB) és la teoria de l'enllaç químic que explica l'enllaç químic entre dos àtoms. Els dos àtoms comparteixen l'electró aparellat per formar un orbital ple per formar una orbita híbrida i un enllaç. Els enllaços sigma i pi formen part de la teoria dels enllaços de valència
Què passa amb l'energia d'enllaç quan augmenta el nombre de massa?
La figura anterior il·lustra que a mesura que augmenta el nombre de massa atòmica, l'energia d'unió per nucleó disminueix per A > 60. En altres paraules, el BE/A ha disminuït. El BE/A d'un nucli és una indicació del seu grau d'estabilitat. En general, els nuclids més estables tenen un BE/A més alt que els menys estables
