
- Autora Miles Stephen [email protected].
- Public 2023-12-15 23:34.
- Última modificació 2025-01-22 16:56.
Línies d'emissió es produeix quan els electrons d'un àtom excitat, element o molècula es mou entre nivells d'energia, tornant cap a l'estat fonamental. El línies espectrals d'un concret element o molècula en repòs en un laboratori sempre es produeixen a les mateixes longituds d'ona.
De la mateixa manera, es pregunta què signifiquen les línies d'un espectre d'emissió?
Línia d'emissió . An línia d'emissió apareixerà en a espectre si la font emet longituds d'ona específiques de radiació. Això emissió es produeix quan un àtom, element o molècula en estat excitat torna a una configuració de menor energia. L'energia és igual a la diferència entre els nivells d'energia superior i inferior.
També es pot preguntar, per què l'espectre d'emissió consisteix en línies discretes? Aquesta emissió es produeix en forma de llum d'una determinada longitud d'ona (color). Per tant, atòmic espectres d'emissió representen els electrons que tornen a nivells d'energia més baixos. Cada paquet d'energia correspon a una línia atòmica espectre . No hi ha res entre cada línia, així que el espectre és discontinu.
A més, quines són les longituds d'ona de les línies de l'espectre d'emissió d'hidrogen?
Quatre dels Balmer línies es troben a la part tècnicament "visible" del espectre , amb longituds d'ona més llarg de 400 nm i més curt de 700 nm. Parts de la sèrie Balmer es poden veure al solar espectre . H-alfa és una línia important utilitzada en astronomia per detectar la presència de hidrogen.
Què causa l'aparició de línies en un espectre d'emissió?
El aparició de línies en un espectre d'emissió és causat pel fet que la llum s'allibera quan un electró es mou a un estat d'energia inferior. Quan els àtoms absorbeixen energia s'emocionen i assoleixen un nivell d'energia més alt.
Recomanat:
Què causa l'espectre d'emissió d'un element?

Els espectres d'emissió atòmica sorgeixen dels electrons que cauen des de nivells d'energia més alts a nivells d'energia més baixos dins de l'àtom, s'alliberen fotons (paquets de llum) amb longituds d'ona específiques
En què es diferencien un espectre d'emissió atòmica d'un espectre continu?

Espectre continu: un espectre que té totes les longituds d'ona sense buits en un ampli rang. Espectre d'emissió: quan un electró en estat excitat es mou a un nivell d'energia més baix, emet una certa quantitat d'energia en forma de fotons. L'espectre d'aquesta transició consta de línies perquè els nivells d'energia estan quantificats
L'espectre d'emissió atòmica és un rang continu de colors?

T/F Igual que l'espectre visible, un espectre d'emissió atòmica és una gamma contínua de colors. T/F Cada element té un espectre d'emissió atòmica únic. V/F El fet que només apareguin certs colors en l'espectre d'emissió atòmica d'un element indica que només s'emeten certes freqüències de llum
Per què és diferent l'espectre d'absorció de la clorofil·la a i l'espectre d'acció de la fotosíntesi?
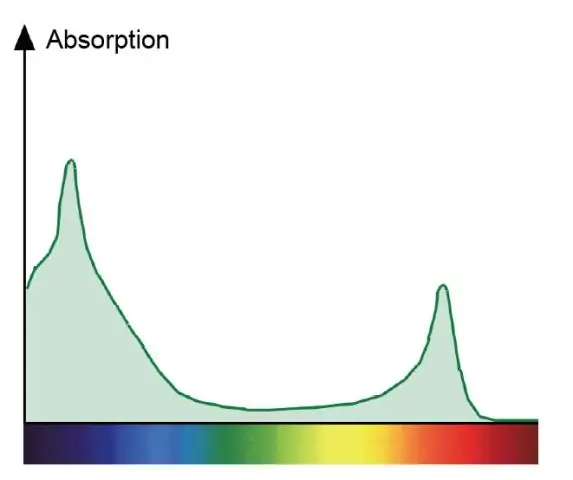
Un espectre d'absorció mostra tots els colors de la llum absorbits per una planta. Un espectre d'acció mostra tots els colors de la llum que s'utilitzen en la fotosíntesi. Les clorofil·les són els pigments verds que absorbeixen el vermell i el blau i participen directament en la fotosíntesi
Quin és l'espectre d'emissió del sol?

L'espectre d'emissió del Sol. El Sol emet radiació electromagnètica en una àmplia gamma de longituds d'ona. El màxim de l'espectre d'emissió solar és d'uns 500 nm, a la part blava-verda de l'espectre visible. A més de la llum visible, el Sol emet radiació ultraviolada i radiació infraroja
